Revelaciones de una cueva*
Juan Pablo Bernal y Gertrudis Uruchurtu

Foto: Turbophoto
Al hablar de cuevas la mente evoca un lugar subterráneo, tenebroso y oscuro. No obstante, hay quienes sienten fascinación por esas tinieblas y al explorarlas han encontrado figuras, imágenes y paisajes de gran belleza. Más todavía, en su interior hay un valiosísimo registro natural del pasado de la Tierra.
A nuestro planeta se le ha venido encima un cambio climático que ya se empieza a manifestar de diversas formas. Conocer lo que sucedió en la Tierra con los cambios climáticos anteriores permite en cierta medida plantear los posibles escenarios futuros y tomar medidas precautorias. Una de las claves de ese conocimiento es el análisis de las estalagmitas que hay en muchas cuevas.
Registro ambiental
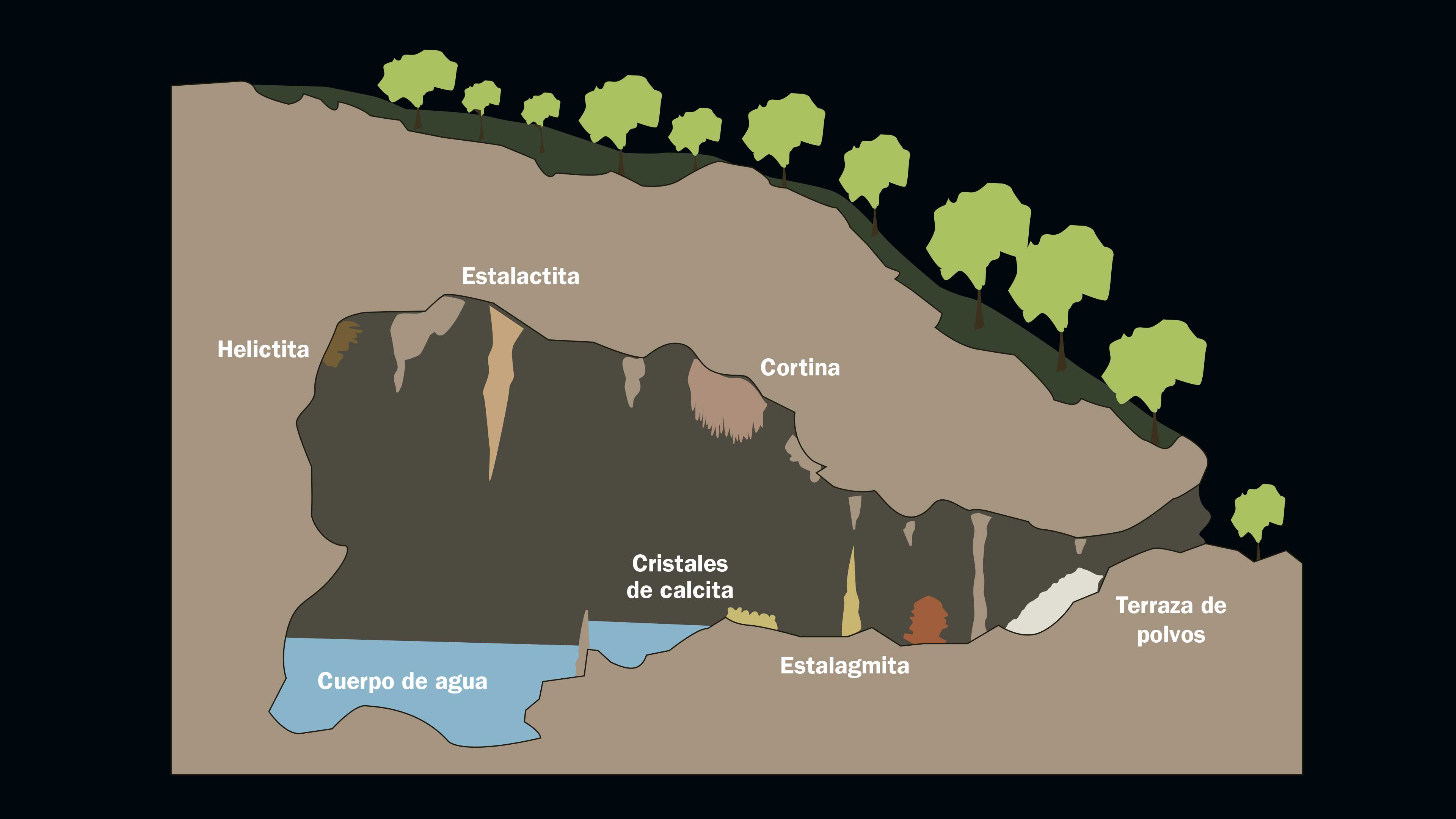
A cualquier cavidad de la corteza terrestre en donde no penetra la luz se le da el nombre de cueva, aunque también se conocen como cavernas o grutas. Hay diferentes tipos de cuevas dependiendo de cómo se formaron. Algunas son "cuevas" desde su origen, como las que se forman al fluir la lava de una erupción volcánica; la parte externa del río de lava se enfría pero en su interior fluye lava caliente que al retirarse deja el hueco de la cueva. Así se forman largos túneles llamados tubos de lava. Pero la mayoría de las cuevas se han formado por procesos lentos que fueron esculpiendo la oquedad durante miles de años. Puede tratarse de una prolongada erosión generada por el viento y el golpe de las olas sobre acantilados en la costa. Otras cuevas se forman a lo largo de fallas geológicas. Y otras más por disolución de la roca; éstas son las más comunes y las que nos interesan aquí porque es donde se forman estalagmitas.
Este tipo de cuevas se hallan distribuidas por todo el mundo, en zonas donde hay roca caliza (cuyo principal componente mineral es el carbonato de calcio) expuesta a la intemperie y en contacto con agua de lluvia. En México las encontramos en muchos lugares, desde Coahuila hasta Chiapas, y desde Yucatán hasta Michoacán. Algunas están entre las más profundas del mundo y han sido exploradas desde hace décadas por espeleólogos mexicanos y de otros países.
La investigación sistemática de las cuevas como archivos de condiciones ambientales antiguas (o paleoambientales) empezó hace unos 15 años en diversos lugares del mundo, como China, Europa, Australia, Sudáfrica, Centro y Sudamérica, en México es más reciente y sobre todo se han estudiado cuevas en los estados de Guerrero y Puebla. Todos estos estudios han permitido determinar cómo ha cambiado el clima del planeta hasta alcanzar su estado actual, y cuáles han sido los principales factores que han modulado el clima a lo largo de los últimos cientos de miles de años. El proceso de formación de cuevas por disolución de roca comienza cuando agua ligeramente acidificada por el dióxido de carbono de la atmósfera y del suelo escurre por las grietas de mesetas de roca que están en la superficie. Esto provoca la disolución lenta de la roca subterránea que generalmente es de piedra caliza pero puede en algunos casos ser de yeso (sulfato de calcio).
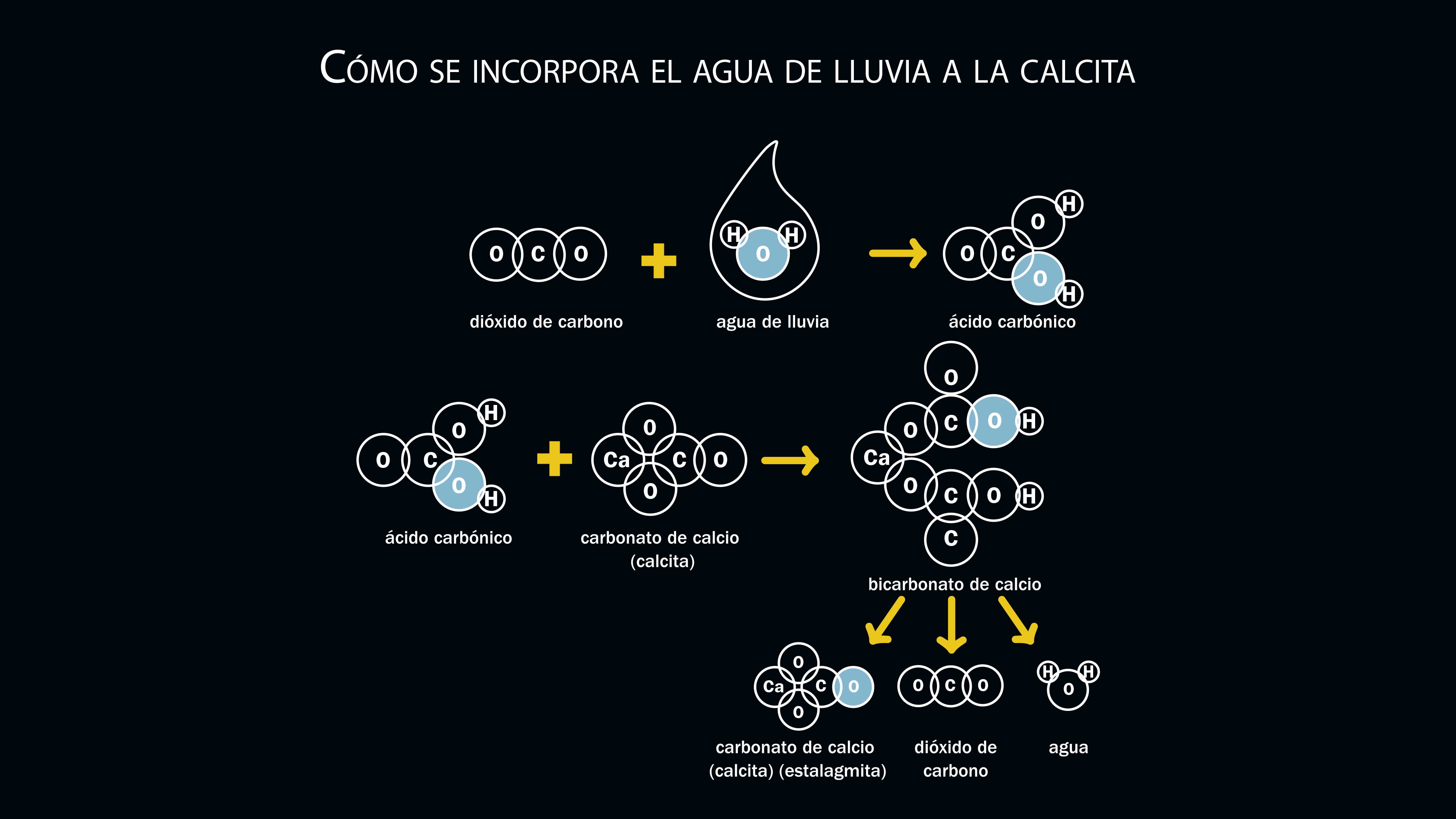
La piedra caliza es ligeramente soluble en agua; sin embargo, si contiene un ácido puede disolverse con mayor facilidad. El dióxido de carbono atmosférico se disuelve en el agua y forma ácido carbónico (H2CO3), un ácido débil que reacciona lentamente con el carbonato de calcio y forma un compuesto soluble que es arrastrado por el agua.
En algunos sitios específicos hay cuevas que se han formado por la acción disolvente del ácido sulfúrico (H2SO4), uno de los ácidos más fuertes.
Cuando el ácido carbónico reacciona con el carbonato de la roca caliza forma bicarbonato de calcio, que se disuelve y es arrastrado al subsuelo, donde escurre lentamente a través de la roca. En el interior de la cueva, el bicarbonato se descompone,alemana y de él se desprende agua, dióxido de carbono y nuevamente carbonato de calcio. El resultado de estas reacciones es que el carbonato es transportado y depositado nuevamente en el interior de las cuevas, en una serie de figuras caprichosas y espectaculares llamadas espeleotemas, que incluyen a las conocidas estalactitas y estalagmitas.
El proceso es el siguiente: cuando la concentración de carbonato de calcio disuelto en el agua llega a un punto crítico, las moléculas de carbonato se separan del agua y se depositan en forma sólida. El primer punto en donde esto sucede es usualmente el techo de las cuevas; así se forman las columnas colgantes llamadas estalactitas. El agua que gotea de las estalactitas puede contener todavía cantidades considerables de bicarbonato de calcio disuelto, por lo que al caer al suelo de la cueva la calcita puede también depositarse en forma sólida, dando origen a otras formaciones cónicas: las estalagmitas.
El crecimiento de estalactitas y estalagmitas es muy lento y depende de muchos factores, como la temperatura y la cantidad de humedad en el exterior de la cueva. En general pueden crecer entre 0.005 y 0.5 milímetros al año.
Estalagmitas
Los geoquímicos han encontrado que la composición de las estalagmitas encierra la historia de los cambios climáticos que ha han ocurrido en la superficie externa de una cueva a lo largo de miles e incluso de millones de años. Su análisis puede darnos información sobre cambios en las condiciones de aridez, en la productividad de la tierra y en la cantidad de lluvia —entre otros parámetros ambientales— a lo largo de diferentes periodos en la zona situada encima de la cueva. En algunos casos es incluso posible observar el efecto de fenómenos meteorológicos como huracanes o incendios forestales ocurridos en el pasado geológico.
El reloj geológico
Para analizar una estalagmita lo primero es conocer el periodo en que ésta creció. Un estudio de las capas que se fueron sedimentando de su base (la parte más antigua) a la punta (la parte más reciente) permite conocer los cambios climáticos que ocurrieron durante su formación.
El procedimiento que siguen los geoquímicos para determinar la edad de la estalagmita se basa en el decaimiento radiactivo de pequeñas cantidades de uranio (número atómico 92 en la tabla periódica). Debido a que las sales que contiene este elemento son solubles en agua de lluvia, éstas pueden ser arrastradas durante el proceso de disolución de la roca caliza y son atrapadas por la calcita en el momento de la sedimentación. En cambio las sales de torio (Th, número atómico 90) son insolubles y no se encontrarán presentes al iniciarse la formación de la estalagmita. Con el paso del tiempo, el decaimiento del uranio, que es un elemento radiactivo, genera torio. Mientras más tiempo haya pasado desde que el uranio quedó atrapado, mayor cantidad de torio (230Th) se habrá formado. De esta manera los geoquímicos miden la relación uraniotorio (238U / 230Th) en distintas partes de la estalagmita, y tomando en cuenta la vida media del uranio y la cantidad de torio que hay en relación con el uranio, calculan cuánto tiempo tuvo que transcurrir para que se generara esa cantidad de torio y, por lo tanto, cuándo se formó la estalagmita.
¿Qué tanto llovió?
Una vez que se cuenta con el fechamiento de las capas de la estalagmita, se hace un análisis cuantitativo de los isótopos del oxígeno contenidos en la caliza: 18O y 16O. Algunos de los átomos de oxígeno de la caliza provienen del agua que la disolvió en la superficie y le permitió escurrir al interior de la cueva.
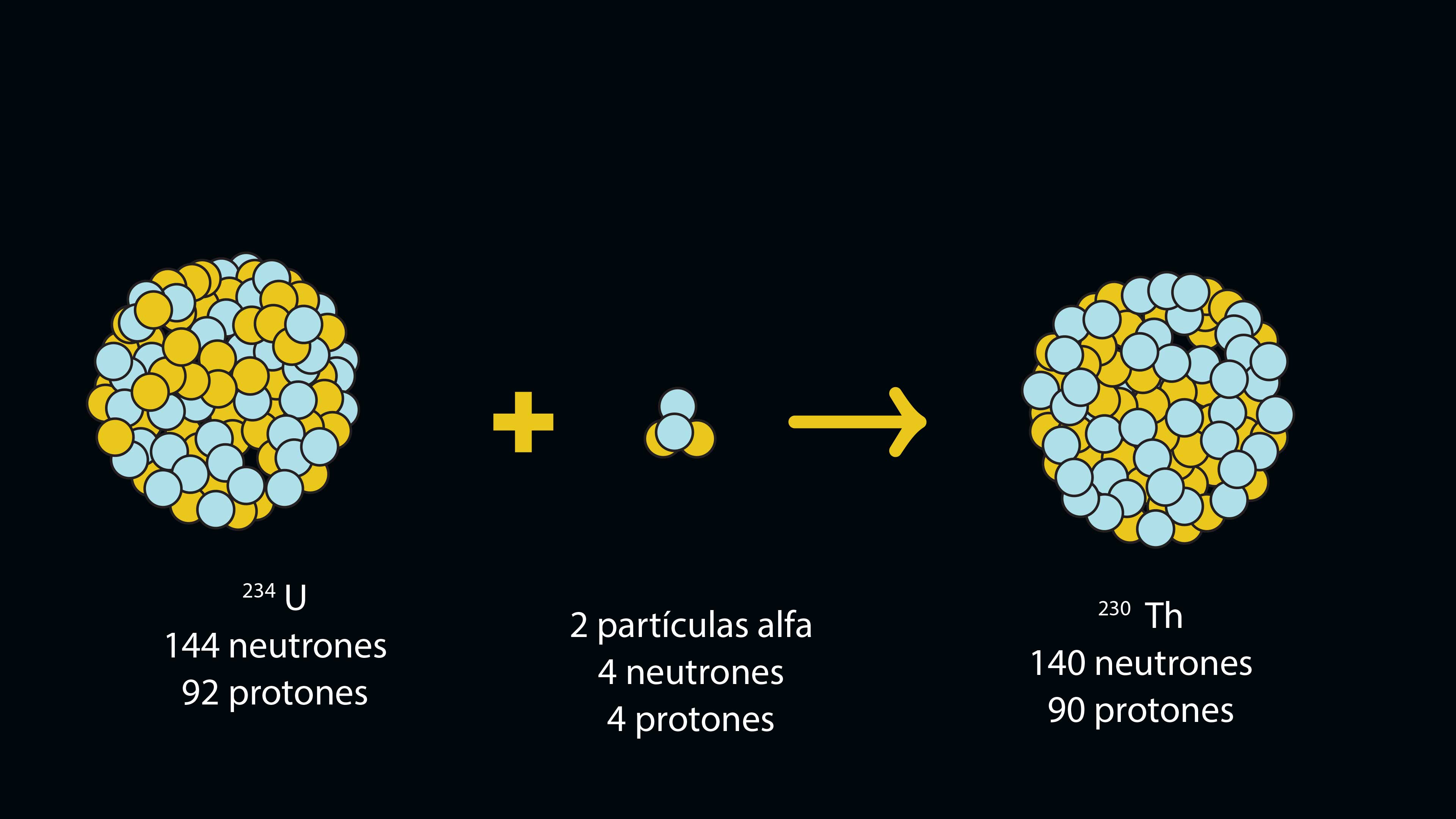
Decaimiento uranio-torio
Los núcleos de los átomos muy pesados (del bismuto en adelante en la tabla periódica) son muy inestables y tienden a desintegrarse en forma espontánea en el fenómeno que se conoce como radiactividad. Al hacerlo liberan partículas alfa; éstas constan de dos protones y dos neutrones (como núcleos de helio). Como el número de protones en el núcleo es lo que le confiere identidad a un átomo, si éste pierde protones, se transforma en otro elemento. De esta manera, el isótopo del uranio que tiene una masa de 238 (144 neutrones y 92 protones), al perder dos partículas alfa se convierte en el elemento torio, de masa 230 (140 neutrones y 90 protones).
Los físicos nucleares han determinado la vida media de los elementos radiactivos; ésta equivale al tiempo que transcurre para que la mitad de los átomos de un elemento dado "decaiga" o se transforme en el elemento de menor peso atómico. La vida media de algunos de estos elementos puede ser de 245 000 años, como es el caso del 234U; la del 230Th es de 75 000 años.
El análisis para medir la proporción en que se encuentran el 18O y el 16O se realiza mediante un espectrómetro de masas, un aparato que separa a los átomos según su masa. Los átomos son neutros, ya que tienen el mismo número de electrones (-) que de protones (+). La muestra que se va a analizar primero se ioniza: una potente corriente de electrones choca con ésta y arranca un electrón a cada átomo. Éstos ya no serán neutros, pues contienen más protones (+) que electrones (-), son iones positivos. Las partículas con carga positiva se hacen pasar por un campo magnético que desvía su trayectoria (los átomos neutros no se desvían por un campo magnético). La proporción en que las partículas se desvíen de su trayectoria depende de su masa. Los iones de menor masa (en este caso los de 16O) sufren mayor desviación que los más pesados (18O). Un detector registra las trayectorias de cada isótopo y la cantidad que hay de cada uno.
Se ha calculado que en el agua de mar por cada molécula de 18O hay, en promedio, 2 500 de 16O. Sin embargo, cuando el agua se encuentra en la atmósfera hay factores que pueden hacer variar ligeramente esa proporción al provocar una separación de las moléculas de agua que contienen los dos diferentes isótopos. Las moléculas de agua que contienen 18O son más pesadas que las que contienen 16O, por lo tanto estas últimas tienen mayor tendencia a difundirse cuando baja la temperatura y a emigrar a latitudes más cercanas a los polos. Por el contrario, las que contienen 18O tendrán mayor tendencia a condensarse y caer en el agua de lluvia. Ésta contiene una mayor proporción de 18O que la humedad atmosférica, que es más rica en 16O.
Los dos principales factores que modulan la cantidad de 18O en el agua de lluvia de un lugar en particular son la temperatura a la que el vapor de agua se condensa en la atmósfera, y la cantidad de lluvia. El segundo factor es más importante en las zonas tropicales del mundo, pues las variaciones estacionales en la cantidad de 18O son relativamente constantes entre distintos años, y son resultado de las mismas variables climáticas.
Como la calcita de las estalagmitas incorpora en su molécula el oxígeno del agua de lluvia, el carbonato de calcio contendrá entonces una cantidad de 18O proporcional a la de las lluvias de ciertos periodos. Por eso al conjuntar el fechamiento de una estalagmita y las posibles variaciones en la relación isotópica de 16O / 18O del carbonato de calcio, los geoquímicos logran reconstruir la historia de la precipitación pluvial de diferentes zonas, y han encontrado que los periodos de intensas lluvias alternan con los de sequía en forma cíclica.
Por otra parte, la presencia y la proporción de algunos elementos metálicos en las cuevas se relaciona con la cantidad de lluvia en épocas determinadas. Una mayor cantidad de magnesio o de estroncio que de calcio en una capa específica de las estalagmitas, se relaciona con una época de sequía en la superficie. En cambio, aquellas épocas en que la tierra fue fértil y productiva dejaron su huella depositando en las estalagmitas una mayor proporción de ácidos húmicos y fúlvicos, que resultan de la descomposición de la materia orgánica y dan lugar a lo que conocemos como humus. Asimismo, estudios recientes han encontrado que los incendios forestales pueden ser la causa de una mayor cantidad de yodo en las estalagmitas, por lo que al observar sus cambios relativos es posible hacer una reconstrucción de la frecuencia de los fuegos forestales que afectaron la zona en el pasado geológico.
Es así como cada día los geoquímicos logran arrancarle más secretos a las cuevas sobre lo ocurrido en la superficie de la Tierra en el pasado.
Isótopos
En el núcleo de los átomos se encuentran los protones y los neutrones. El número de protones es fijo para cada elemento y es lo que le da su identidad. . El número de neutrones, en cambio, puede variar. Aquellos átomos que tienen el mismo número de protones pero diferente número de neutrones reciben el nombre de isótopos. Entre los isótopos lo único que varía es la masa atómica, pues mientras tengan el mismo número de protones sus propiedades químicas serán las mismas. El número de isótopos que tiene un elemento varía de uno a otro. El xenón, por ejemplo, tiene nueve isótopos, todos con 54 protones. Por otra parte, el oxígeno tiene tres, de los cuales todos tienen ocho protones, pero pueden tener ocho, nueve o 10 neutrones. Su comportamiento químico es el mismo aunque su masa varíe.
La manera de representar a los isótopos es mediante un superíndice colocado a la izquierda del símbolo del elemento correspondiente, que equivale a su masa atómica, la suma de protones y neutrones: 16O, 17O, 18O. En todos los casos alguno de los isótopos es el más abundante.
El número que aparece en la tabla periódica como masa atómica es la masa promedio de todos los isótopos de ese elemento. En el caso del oxígeno el 99.76 % de los átomos son 16O, el 0.2% son 18O, y 0.04% son 17O.

Juan Pablo Bernal es investigador en el Centro de Geociencias de la Universidad Nacional Autónoma de México, Campus Juriquilla.
Gertrudis Uruchurtu es química farmacobióloga y frecuente colaboradora de ¿Cómo ves? Durante 30 años fue maestra de química de bachillerato y es egresada del Diplomado de Divulgación de la Ciencia de la DGDC-UNAM