Células madre: el futuro que llegó
María Emilia Beyer Ruiz
Shutterstock
Las realidades, dilemas éticos y promesas médicas de un campo de investigación en efervescencia.
Las noticias sobre tratamientos a partir de células madre no dejan de sorprender. Sin duda, estas células genéricas, capaces de generar todos los tipos diferentes de células que existen en un organismo, son el tesoro biológico del siglo XXI. Comprender a cabalidad su funcionamiento ocupa la mente y los recursos de miles de científicos de todo el mundo, y por buenas razones. De las células madre se esperan herramientas para tratar problemas de salud que abarcan desde quemaduras de piel hasta trasplantes de córnea, riñón e hígado. Los medios de comunicación las aclaman como la salvación para la ceguera, la calvicie y las arrugas; o las presentan como futura solución para enfermedades como la diabetes tipo 1, el mal de Alzheimer y el mal de Parkinson. Aunque parece exagerado, los resultados que se reportan cada año nos permiten soñar con que el futuro ya está, prácticamente, a la vuelta de la esquina.
Maravillas a la vista
En 2014 tres personas con lesiones de la médula espinal recibieron inyecciones de células madre derivadas de tejido nervioso de embrión en el Hospital Universitario Balgrist, de Zúrich, Suiza. Seis meses después del tratamiento, dos de los pacientes ya podían sentir en la piel estímulos como presión, frío, calor y toques eléctricos. Para 2015, dos personas más habían reportado las mismas mejorías. Si bien la noticia brindó resultados esperanzadores para las personas con parálisis, el camino por recorrer es todavía muy largo: el tratamiento les devolvió a los pacientes la sensación en la piel, pero no mejoró la función del organismo. Las lesiones de la médula espinal involucran una gran cantidad de factores que van más allá de unas cuantas células dañadas. Además, cada lesión es diferente, y de acuerdo con sus características, cambia drásticamente el ambiente en el que viven las células (se liberan toxinas al torrente sanguíneo, se generan cicatrices que imposibilitan movimientos, etcétera). Las inyecciones de células madre para tratar parálisis son un buen comienzo, pero todavía falta que los científicos comprendan cabalmente los mecanismos que promueven las mejorías. Sin esta comprensión, no se puede pensar en tratamientos efectivos a gran escala, y por el momento la investigación se mantiene en fase de estudio clínico. Sin embargo, a pesar de las fallas y los espacios en blanco, las células madre son la posible solución para muchas enfermedades y padecimientos.
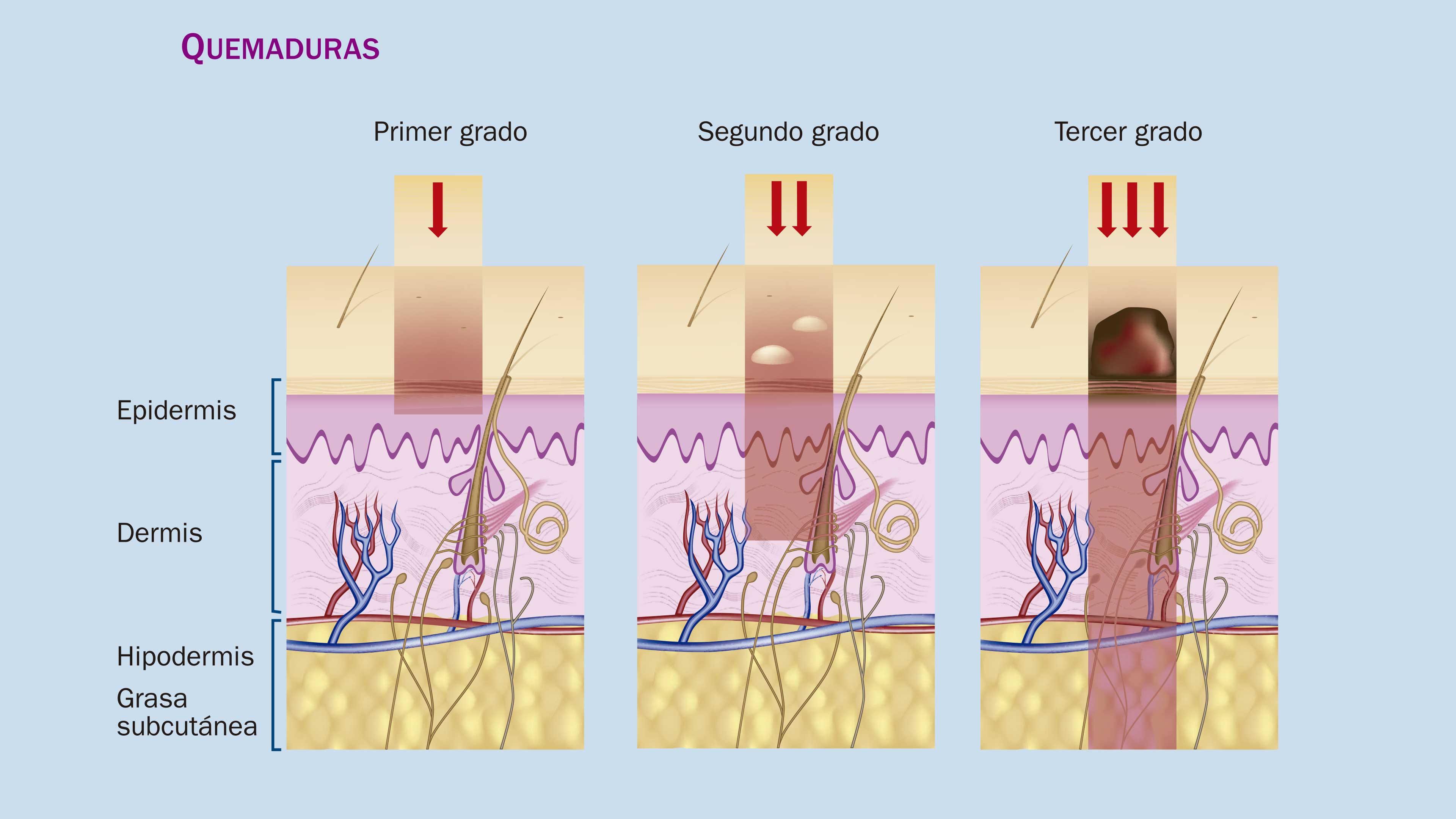
La promesa médica de los tratamientos a partir de células madre comienza a cristalizarse y sus hallazgos parecen provenir de la ciencia ficción. Mientras un equipo desarrolla extensiones de piel en una cajita de Petri para sustituir los segmentos dañados en pacientes que sufrieron quemaduras graves, Harald C. Ott, del Hospital General de Massachusetts, observa con atención el primer riñón de rata diseñado y construido en un laboratorio a partir de un puñado de células alimentadas cuidadosamente en una caja de vidrio, y se emociona cuando descubre que el órgano es capaz de filtrar orina. El posterior trasplante del riñón a una rata viva demostrará si el órgano funciona tanto en el laboratorio como en un sistema vivo. Al mismo tiempo, Mark Post, de la Universidad de Maastricht, Países Bajos, presenta al mundo la primera hamburguesa de carne generada en un laboratorio a partir de células madre de vaca. Es una época de realidades combinadas con maravillas.
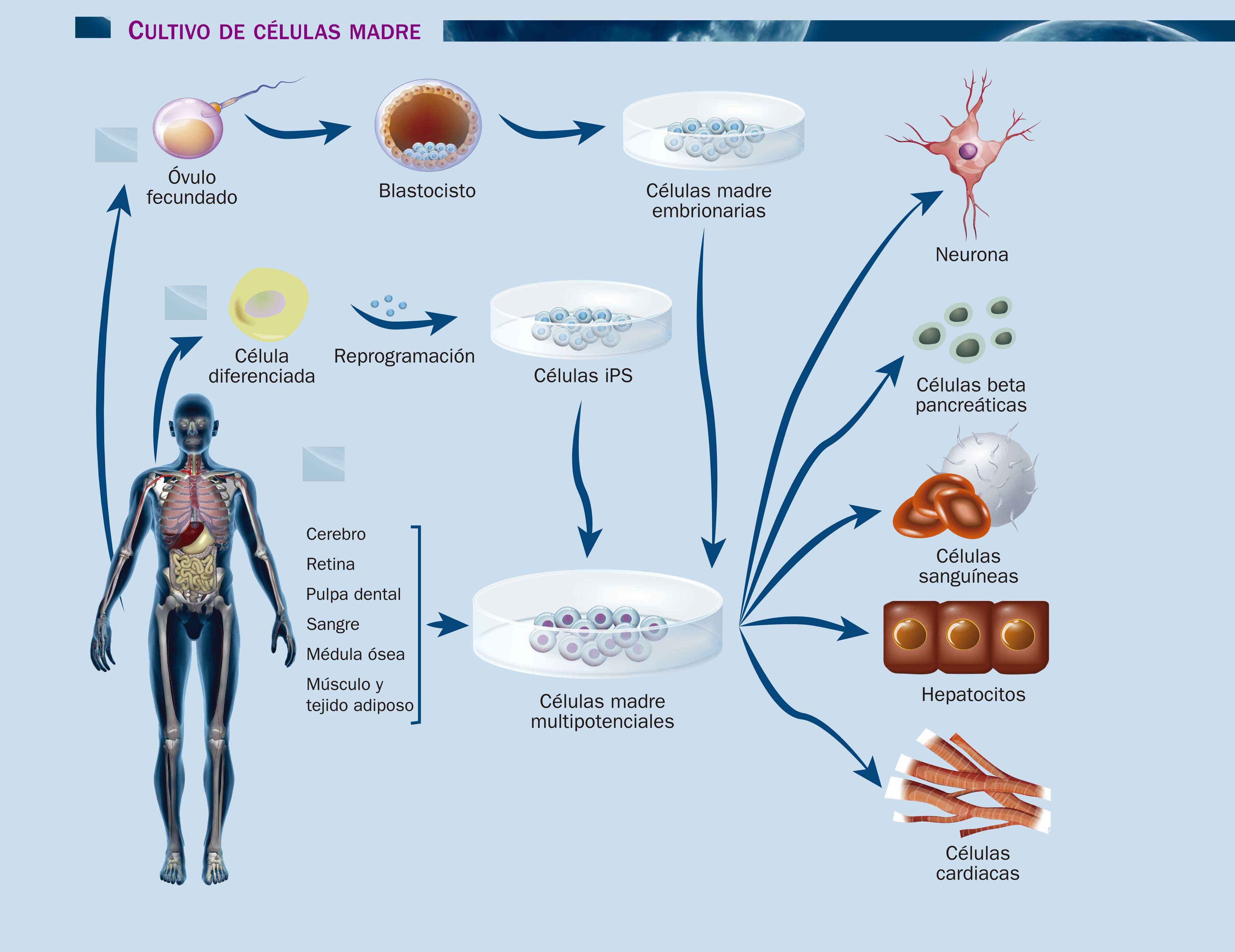
El origen sí importa
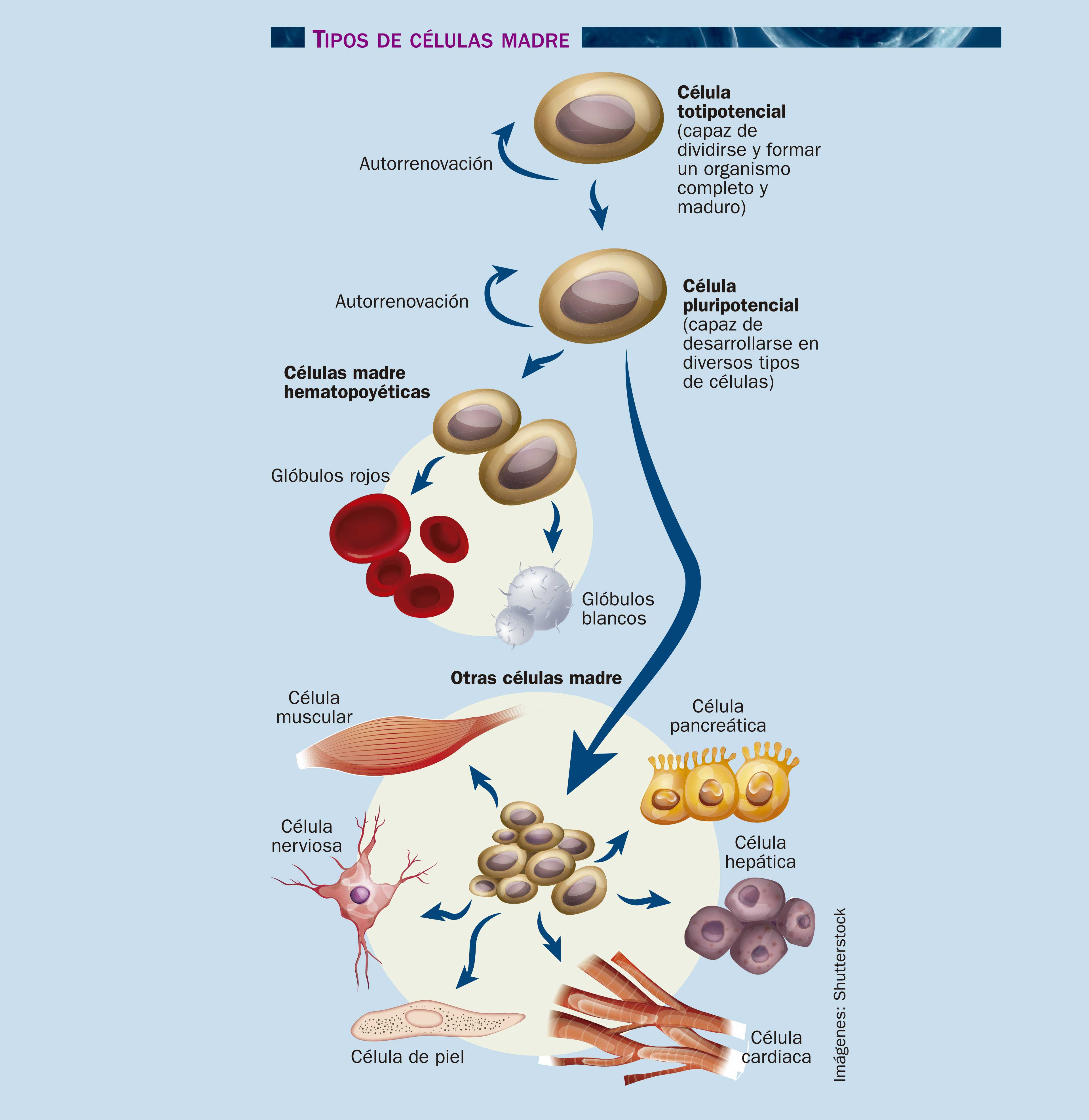
No se puede hablar de células madre sin considerar el dilema ético que acompaña constantemente al tema, y éste se reduce a esta pregunta: ¿de dónde provienen las células que se usan en una investigación o un tratamiento? Al principio la fuente de células madre por definición era el blastocisto, etapa temprana del embrión que se forma a los pocos días de la fertilización. Las aproximadamente 200 células del blastocisto son muy especiales, pues pueden generar todas las células del organismo. Por ser capaces de generar células de cualquier tipo, a las células madre embrionarias se les considera pluripotenciales. Para obtenerlas hay que destruir el blastocisto, por lo que la investigación con células madre pluripotenciales está sujeta a un apretado esquema de lineamientos éticos y constante vigilancia a nivel mundial.
Por fortuna, en las últimas dos décadas se han descubierto reservas de células madre en el organismo adulto, lo que podría permitir sacarle la vuelta al problema de obtenerlas de embriones. La desventaja es que las células madre de adulto son pocas y no son tan flexibles ni duraderas como las de embrión.
Las células madre se encuentran en la médula espinal, la pulpa de los dientes, la retina, la sangre, la placenta y el cordón umbilical, por mencionar algunas fuentes. La doctora Mayana Zatz, de la Universidad de Sao Paulo, Brasil, comenta con buen humor que su investigación sobre distrofia muscular con células madre se verá beneficiada con muchos donantes ahora que su equipo ha obtenido células madre a partir del tejido adiposo que se extrae durante la liposucción. Estas células derivadas de la grasa se han usado en el laboratorio para producir distrofina, una proteína esencial para el funcionamiento de los músculos que deja de producirse en las células de las personas con distrofia muscular. El procedimiento ha funcionado en roedores y perros con este padecimiento, por lo que en los próximos años se auguran ensayos clínicos con seres humanos.
Así de pronto, aunque sea en cantidades pequeñas, ¡las células madre no embrionarias están hasta en la grasa! La función natural de estas células es dividirse para producir células de tipos específicos para regenerar los tejidos que las rodean. Dentro del organismo, estas células sólo dan lugar a ciertas clases de células, por lo que se les llama multipotenciales: las células madre hematopoyéticas, por ejemplo, restituyen constantemente las plaquetas, los glóbulos blancos y los glóbulos rojos de la sangre, pero son incapaces de generar células cardiacas, de músculo o neuronas. A pesar de no ser tan flexibles como las pluripotenciales, estas células son una fuente fantástica para la investigación en células madre.
Volver al futuro
En 2006 el médico japonés Shinya Yamanaka hizo un descubrimiento que revolucionó nuestra comprensión de la fisiología celular. Yamanaka, médico especializado en lesiones graves de la médula espinal, se integró a los numerosos grupos de científicos que ya investigaban el funcionamiento de las células madre en la Universidad de Tokio. Pero Yamanaka aportó una perspectiva diferente: mientras que otros grupos intentaban dirigir una célula madre hacia el tipo celular que se requería (es decir, dirigir el proceso "hacia adelante"), a Yamanaka le interesó más comprender el proceso de la célula especializada siguiendo las pistasen reversa hasta el origen. El investigador se preguntaba por qué las células madre diseminadas aquí y allá en el cuerpo del adulto podían permanecer en ese estado en lugar de correr con la misma suerte que sus vecinas y transformarse en células más especializadas. En otras palabras, le interesó encontrar la esencia de la pluripotencialidad. Las células madre tienen la capacidad de producir células que se comportarán como ellas, no sufrirán especialización alguna y seguirán produciendo células madre en un proceso de constante renovación de esta reserva biológica tan valiosa. Pero también pueden dar lugar a células hijas que prosigan otros caminos y que respondan a las señales del ambiente para convertirse en células de la sangre, en neuronas, en células de hígado, en células cardiacas, musculares y de todo tipo.
En palabras de Austin Smith, de la Universidad de Cambridge, a Yamanaka le atrajo el momento en el que la célula madre "tiene que tomar una decisión: dar lugar a células hijas que a su vez actúen como células madre, o dar lugar a células hijas que continúen procesos fisiológicos de diferenciación hasta convertirse en células especializadas". En una entrevista, Yamanaka narra que su investigación partió de considerar que en una misma persona, una célula pluripotencial y una célula de la piel contienen la misma información genética. Lo que las hace tan diferentes en función y en forma es que no están activos los mismos segmentos de ADN.
Yamanaka supuso que si conseguía introducir en la célula de piel los factores bioquímicos que dan instrucciones para que se detenga el proceso de diferenciación, se podía reprogramar esta célula madura ya diferenciada para revertir su especialización; es decir, hacerla retroceder en el tiempo para que se comporte otra vez como célula madre. Yamanaka comenzó por identificar los factores capaces de fomentar la reprogramación celular. Inicialmente, el investigador y su equipo consideraron una centena de proteínas que podían actuar juntas o separadas. Esto daba lugar a más de un millón de combinaciones, pero la respuesta final resultó sorprendentemente sencilla: bastó añadir, mediante un retrovirus, cuatro factores al cultivo de células de piel para obtener la reprogramación celular. Estos factores, llamados Sox2, Oct4, c-Myc y Klf4, actúan al mismo tiempo en las células madre embrionarias y en conjunto constituyen la esencia de la pluripotencialidad. A las células madre resultantes Yamanaka las bautizó como células madre pluripotenciales inducidas (iPS, por sus siglas en inglés). Su hallazgo abrió la posibilidad de hacer investigación con células madre que no provengan de embriones. Actualmente, las iPS se cultivan a gran escala en los laboratorios del mundo. Por este hallazgo Shinya Yamanaka recibió el Premio Nobel de Fisiología o Medicina en 2012.
La caída de Ícaro
Las promesas de las células madre han deslumbrado a más de uno del mismo modo que el mítico Ícaro se deslumbró por la belleza del Sol y perdió sus alas de cera por acercarse demasiado. Esto ha llevado a algunos escándalos. Uno de los casos más sonados es el del científico surcoreano Hwang Woo-suk. Este investigador apareció en los medios de comunicación más importantes del mundo durante el 2004 y el 2005, cuando anunció hallazgos relacionados con la creación de líneas celulares pluripotenciales obtenidas a partir de núcleos de células maduras, entre otros hallazgos. La revista Science publicó sus artículos, en los que se apreciaban varias líneas celulares aparentemente perfectas y magníficas para la investigación, pero al poco tiempo varios científicos de diversos lugares del mundo comenzaron a detectar fallas en las imágenes y en la metodología. El escándalo creció en 2006, cuando se descubrió que Woo-suk había obligado a varias de sus estudiantes a "donar" material biológico para la investigación. Woo-suk estuvo, incluso, a punto de ir a la cárcel.
El escándalo más reciente sucedió en 2014, cuando la investigadora Haruko Obokata, del Centro Riken, en Kobe, Japón, publicó en la revista Nature una metodología asombrosamente sencilla para generar células madre a partir de baños con agentes ácidos ¡en 30 minutos! El procedimiento, conocido como STAP por sus siglas en inglés, estaba avalado por Yoshiki Sasai, un prestigiado científico en el campo de la investigación con células madre. Cuando surgieron los ataques, ambos científicos defendieron el trabajo. Sin embargo, el Centro Riken se vio presionado a formar un comité y realizar una investigación. El resultado de estas pesquisas determinó que Obokata había manipulado datos, exagerado resultados y que incluso utilizó imágenes de dos experimentos distintos para que sus datos parecieran más impactantes. En una rueda de prensa, Obokata ofreció disculpas por lo que calificó como errores involuntarios y atribuyó los problemas "a su inmadurez como científica", pero defendió la metodología STAP. Aunque Yoshiki Sasai quedó libre de sospechas, la comunidad científica le hizo duras críticas, pues resultaba evidente que no había revisado los trabajos con atención, como correspondía al tutor de las investigaciones. En un acto que parece salido de una película de samuráis más que de la vida real, el 5 de agosto de 2014 Sasai se ahorcó en las escaleras de la institución que lo vio crecer como científico. Obokata renunció en diciembre de ese año. Como Ícaro, ambos se quemaron las alas por querer volar demasiado alto.
Por seguridad
Según el portal Eurostemcell, para que la investigación con células madre pueda convertirse en un procedimiento seguro y de rutina necesita cumplir un conjunto de condiciones, que incluyen:
1. La capacidad de generar suficientes células madre que puedan ser dirigidas en el laboratorio para producir una cantidad suficiente de células diferenciadas.
2. Que los cultivos de células madre reciban los nutrimentos y cuidados necesarios para evitar infecciones bacterianas o virales que modifiquen los resultados o la identidad celular. Las células especializadas que se obtengan a partir de las células madre deben estar perfectamente sanas.
3. Las células resultantes deben sobrevivir al trasplante, y una vez conseguido este paso, integrarse y funcionar según lo establecido por los investigadores.
4. Las células trasplantadas no deben generar cambios inesperados ni daños en el organismo.
Realidades y promesas
La investigación en células madre es fascinante. Las promesas, increíbles. La solución de los grandes problemas de salud de la humanidad parece estar al alcance de la mano, creciendo silenciosa en cajitas de Petri. Hasta la fecha, los científicos han aprendido a nutrir y cuidar los cultivos de células madre para generar, por ejemplo, pequeños órganos que se estudian en el laboratorio, como proto-hígados y mini-estómagos. Estos últimos, llamados organoides gástricos, tienen el tamaño de un chícharo y se usan para estudiar infecciones que atacan al estómago humano. James Wells, líder del equipo que produjo los estómagos miniatura a partir de células madre, indica que los animales de laboratorio no se enferman de lo mismo que nosotros; por lo tanto, estudiar en el laboratorio los organoides gástricos y sus interacciones con el ambiente puede brindar avances importantes en el tratamiento de úlceras y otros padecimientos.
Pero hay que andar con tiento: la comunidad científica advierte que, incluso en las terapias exitosas, se desconoce una gran cantidad de información. A veces los cultivos dan lugar a carcinomas. Se sabe que dos de los cuatro factores que se utilizan para la reprogramación celular descrita por Yamanaka son activos en la proliferación de células cancerosas. También puede suceder que las células madre resuelvan algunos problemas, pero no todos, por lo que no hay que abandonar la investigación de otras metodologías complementarias. Por ejemplo, cuando se cultivan segmentos de piel a partir de células madre donadas por el propio paciente, se reduce el riesgo de que el cuerpo rechace el injerto, pero esta película resuelve únicamente el daño en las capas superiores, o epidermis, por lo que los pacientes obtienen, a final de cuentas, una solución "superficial". A niveles más profundos, la película de piel no tiene la capacidad de integrarse al organismo por completo y no se generan nuevas glándulas sudoríparas ni folículos pilosos.
El Reino Unido, España, Francia, Suecia y Estados Unidos son los países que dominan las investigaciones con células madre. Se espera que los próximos años nos traigan revoluciones que anteriormente parecerían el producto de imaginaciones desbocadas o de la ciencia ficción. Pero las células madre siguen invitándonos a descubrir sus posibilidades, y si bien todavía quedan secretos por revelar, las metodologías fundamentales para su estudio ya están bien establecidas. El futuro, en suma, llegó para quedarse.
Más información
- Nombela Cano, César, Células madre, Ed. Catarata, Madrid, 2010.
- Bueno Torrens, David, Órganos a la carta: células madre, clonación terapéutica y medicina regenerativa, Edicions de la Universitat de Barcelona, Barcelona, 2007.
- Liceaga Reyes, Rodrigo, "Células madre dentales", Revista Ciencia y Desarrollo, CONACYT, México, julio-agosto 2011.
María Emilia Beyer es divulgadora de la ciencia y bióloga de profesión. Es pasante de la maestría en Filosofía de la Ciencia de la UNAM. Actualmente trabaja en la Dirección General de Divulgación de la Ciencia de la UNAM