Edición genética en humanos, la gran controversia
Benjamín Ruiz Loyola, Jorge Benjamín Ruiz Gutiérrez

Ilustraciones: Shutterstock
Lulu y Nana, rostros de la edición genética en humanos
Una novedosa forma de ingeniería genética podría curar numerosas enfermedades, pero también tiene complejas implicaciones técnicas, legales y éticas. Todo depende de cómo y para qué se aplique.
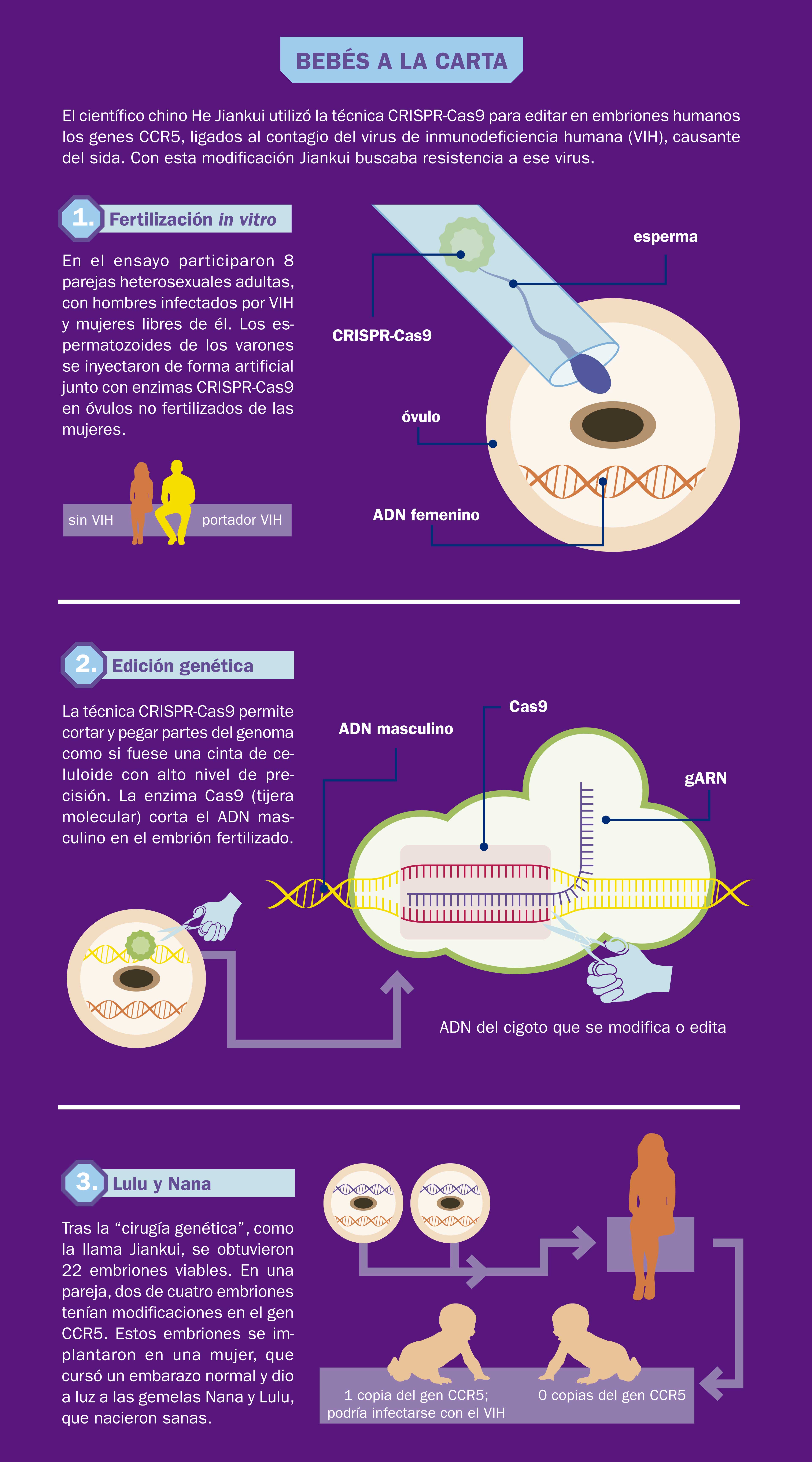
“Dos niñas chinas llamadas Lulu y Nana llegaron al mundo llorando tan sanas como cualquier otro bebé”, anunció el 25 de noviembre de 2018 en You Tube el investigador He Jiankui, profesor de la Universidad de Ciencia y Tecnología del Sur de China. En el video el científico narraba que la gestación de las niñas se inició mediante un procedimiento de fecundación in vitro. He y su equipo obtuvieron esperma del padre, quien está infectado con el virus de inmunodeficiencia humana (VIH), y óvulos de la madre, que no está infectada. Los óvulos se fecundaron en el laboratorio. Por cada óvulo fecundado se formó un huevo, o cigoto, de una sola célula que inmediatamente después se duplicó en dos, cuatro, ocho... hasta formar un blastocisto, es decir, un embrión de cinco días, con aproximadamente 200 células. Como punto de comparación, consideremos que el cuerpo humano adulto está hecho de unos 37 000 000 de células. En el experimento de He, al momento de la fecundación, cuando se unieron el óvulo y el espermatozoide, se agregó una proteína con instrucciones para modificar la información genética del cigoto, tras lo cual dos de estos embriones modificados fueron implantados en el útero de la madre. Meses después nacieron Lulu y Nana.
Editar o no editar
Durante años científicos y filósofos nos habían advertido sobre los riesgos de crear embriones humanos genéticamente modificados con la intención de llevar a término la gestación, pero esto sucedió antes de lo que muchos habían previsto. En 2015 se reunieron expertos de todo el mundo en la primera Cumbre de Edición Genética en Humanos para discutir, entre otras cosas, la posibilidad de editar genéticamente embriones humanos. Al final de la reunión el comité organizador escribió una declaración que establece que sería irresponsable realizar edición genética en células germinales —las que pueden transmitir su información genética a la descendencia, como óvulos y espermatozoides— hasta que los criterios de eficacia y seguridad de la técnica fueran resueltos y hasta que hubiera un consenso sobre lo apropiado de la aplicación propuesta. El documento termina señalando que hasta hoy estos criterios no existen para ninguna aplicación clínica. El asunto de lo ético de esta tecnología sigue pendiente.
La edición genética consiste en modificar el ADN de una célula o de un organismo para cambiar sus características. Editar la cadena del ADN es como editar la cadena de fotogramas que forman una cinta cinematográfica: se corta en el lugar preciso en que se quiere hacer la modificación y se extrae una secuencia, o bien se inserta otra distinta en su lugar y se vuelve a pegar la cinta. La técnica más común, eficaz y barata para editar genomas es CRISPR (se pronuncia “crisper”, por las siglas en inglés de “repeticiones palindrómicas cortas agrupadas y espaciadas regularmente”, véase ¿Cómo ves? Núm. 200).
Para realizar la edición genética primero es necesario reconocer la región específica del ADN que se desea modificar. Sin embargo podrían existir otras regiones en el genoma con secuencias parecidas en las que, sin planearlo, ocurran cambios adicionales al deseado, lo que en algunos casos puede traer consecuencias negativas.
Edición genética en el ADN
Todos los organismos poseen información genética almacenada en la molécula de ADN, que se encuentra en el núcleo y en las mitocondrias de casi todas sus células. La información genética está escrita en un código consistente en cuatro letras. Estas “letras” son moléculas distintas que forman los escalones de la doble hélice del ADN. El ADN humano está compuesto de una secuencia de aproximadamente 3 000 millones de letras. Una alteración en la secuencia se conoce como mutación. Las mutaciones pueden causar enfermedades que podrían heredarse a las generaciones posteriores. Estas mutaciones naturales pueden corregirse por medio de edición genética.
Aplicaciones y advertencias
Por una parte, la edición genética puede utilizarse para entender las funciones de los genes humanos. Por ejemplo cómo se desarrollan los embriones, la relación entre algunas enfermedades y los genes y la evolución de enfermedades como el cáncer y otras condiciones que tienen un componente genético importante.
Por otra parte, una posible aplicación clínica consiste en usar la edición genética para curar enfermedades hereditarias causadas por mutaciones en un solo gen. Actualmente se conocen más de 10 000 de estas enfermedades monogénicas, las cuales afectan a millones de personas de todo el mundo. Esta tecnología se ha empleado para estudiar distintas enfermedades y tratar de desarrollar tratamientos efectivos, por ejemplo en la infección por VIH y la enfermedad neurodegenerativa de Huntington. Para ello se utilizan células u organismos de especies no humanas, como ratones.
La edición genética se puede realizar en dos tipos de células: las somáticas y las germinales. Casi todas las células del organismo son somáticas (por ejemplo, las células de la piel, el hígado, los músculos, los huesos o la sangre). Los cambios genéticos efectuados en este tipo de células permanecen en el organismo o célula en el que ocurrieron. No se transmiten a los descendientes. Si ocurrieran modificaciones imprevistas e indeseables en el ADN, las consecuencias afectarían únicamente al organismo en el que se realizó el cambio y no pasarían a generaciones futuras. En las células germinales es distinto, pues un óvulo fertilizado por un espermatozoide puede dar lugar a un ser humano. Ya se han realizado experimentos de edición genética en cigotos formados por entre cuatro y ocho células y en embriones más desarrollados, los cuales nunca antes se habían implantado para producir bebés. Los cambios realizados en el ADN de óvulos, espermatozoides, cigotos o embriones sí se transmitirán a las generaciones futuras, serán hereditarios. Si la edición genética tuviera consecuencias negativas, estas afectarían a los descendientes.
Algunos países aprueban la creación de embriones humanos para usarse en experimentos científicos siempre y cuando los donadores de los óvulos y espermatozoides estén informados del uso que se dará a sus células. Algunos grupos de investigación utilizan embriones humanos supernumerarios, es decir, los que sobran de los tratamientos de reproducción asistida (en los que se crean varios embriones pero sólo se implanta uno o dos). En algunos países el uso de embriones está regido por leyes, por lo que se les pide a los científicos que justifiquen la necesidad y utilidad de usarlos. También se les pide que limiten el número de embriones utilizados y que para optimizar los protocolos experimentales se use otro tipo de células o embriones de especies no humanas antes de aplicarlos a humanos.
La legislación que regula el uso de embriones para experimentos de edición genética varía de un país a otro. En algunos países como México no hay ley alguna al respecto. Eso sí, en ningún país se aprueba legalmente la implantación de embriones editados genéticamente para dar lugar a un bebé.
Curar enfermedades mortales
La edición genética también se ha utilizado en pacientes con enfermedades que no son hereditarias y para las cuales no hay tratamiento. Es el caso de Layla, una bebé que nació en junio de 2014 y a la que se le detectó leucemia, un tipo de cáncer de las células de la sangre, a los tres meses de nacida. Los glóbulos blancos o leucocitos son un tipo de célula de la sangre que normalmente sirve para combatir enfermedades infecciosas. Los leucocitos de Layla no estaban funcionando bien debido a la leucemia, por lo que estaba destinada a morir.
Los médicos les aconsejaron a los padres, Lisa y Ashleigh, prepararse para lo peor y llevarla a cuidados paliativos. Pero los padres optaron por un tratamiento novedoso que no se había probado en humanos. Era su última opción. Este tratamiento sólo se había probado en ratones de manera experimental y consistía en inyectarle a la bebé células editadas genéticamente. El objetivo del tratamiento con edición genética era que Layla desarrollara leucocitos sanos. “Daba miedo pensar que ese tratamiento nunca se había probado en humanos. Pero Layla estaba enferma con mucho dolor y teníamos que hacer algo”, dijo Ashleigh.
Las células que se le inyectarían a Layla eran glóbulos blancos de un donador sano modificados en un laboratorio. Como resultado de estos cambios, las células adquirieron dos características fundamentales que ayudarían a atacar el cáncer de Layla: 1) mayor resistencia a la quimioterapia, la cual es tan tóxica que usualmente mata las células cancerosas, pero también muchas células sanas, y 2) la habilidad de luchar contra las células cancerosas. Antes de poner en práctica el tratamiento fue necesario discutirlo con el comité de ética del hospital. Finalmente en 2015 los médicos aplicaron el tratamiento a Layla, quien siguió recibiendo quimioterapia para ayudar a eliminar sus células cancerosas. Después de un par de semanas, los médicos anunciaron que el tratamiento estaba funcionando y que se había logrado eliminar las células de cáncer de la bebé y los síntomas de la enfermedad. Posteriormente, para asegurarse de que Layla tuviera un reservorio de glóbulos blancos sanos, se le realizó un trasplante de médula ósea de un donador. Probablemente Layla necesitará usar medicinas el resto de su vida, así como vigilancia constante de su estado de su salud. En 2017 se reportó que a 18 meses de la terapia la niña seguía saludable.
Aun cuando este tratamiento puede sonar exitoso, los médicos de Layla advirtieron que no significa que esta tecnología sea una opción adecuada para todos los niños. Sin embargo, si se logra replicar su efecto podría representar un avance importante en el tratamiento de la leucemia y otros tipos de cáncer.
La gran controversia
Las distintas aplicaciones de la edición genética tienen complejas implicaciones técnicas, legales y éticas. En el experimento de He se modificó el ADN de Lulu y Nana cuando todavía cada una era un cigoto, por lo que es posible que los cambios realizados en su ADN sean transmitidos a sus descendientes, lo que introduciría cambios irrevocables en la especie humana. Estos cambios incluyen tanto los realizados intencionalmente como los que puedan hacerse sin querer.
Tres días después de anunciar el experimento en You Tube, He lo dio a conocer a la comunidad científica internacional en la Segunda Cumbre Internacional de Edición Genética en Humanos realizada en Hong Kong. Como resultado, el comité organizador declaró que ya existían dos documentos que ofrecen una guía de las condiciones en las que se aprobaría el uso de estas técnicas en humanos con fines clínicos. Por ejemplo, uno de estos documentos menciona que los ensayos clínicos se podrían permitir después de discutir el experimento con otros colegas y después de haber evaluado los beneficios y riesgos potenciales, y sólo en caso de haber razones médicas suficientes y en ausencia de alternativas de tratamientos razonables. Además, el proceso se debería realizar con la mayor transparencia.
El objetivo del experimento de He fue modificar el ADN de los cigotos para protegerlos de la posibilidad de contraer la infección de VIH que tiene su padre. Sin embargo, actualmente existen diversas maneras de prevenir la infección y en caso de que se contraiga, existen medicamentos para tratarla. Así pues, no había necesidad médica de realizar la edición genética. He habló de su experimento mucho tiempo después de su inicio y lo registró el 8 noviembre, muy cerca de la fecha de nacimiento de las niñas. Finalmente no está claro si los padres de las niñas entendían cabalmente el propósito y sus potenciales beneficios y riesgos.
En aquella Cumbre, el premio Nobel de Fisiología y Medicina David Baltimore dijo: “Pienso que el proceso no fue transparente. Nos enteramos cuando ya era un hecho y las niñas habían nacido. En lo personal no creo que fuera médicamente necesario… Pienso que esto es una falla en la autorregulación de la comunidad científica debido a la falta de transparencia”. Más de 100 científicos, la mayoría de China, escribieron una carta refiriéndose al trabajo de He y declarando que el uso de CRISPR para editar los genes de embriones humanos era riesgoso e injustificado. Por su parte la Comisión Nacional de Salud de China ordenó una inmediata investigación del caso.
Existen otras preocupaciones éticas que son tan diversas como las distintas culturas, religiones y creencias de todo el mundo. Por ejemplo, algunos filósofos cuestionan si cambiar el ADN de un embrión podría alterar su identidad como ser humano. El doctor He en su presentación durante la cumbre hizo énfasis en el estigma que sufre la gente con VIH en China como una de sus motivaciones para realizar sus experimentos. Pero ¿modificar el ADN de un individuo para evitar la infección resuelve el problema social del estigma, o más bien refuerza la estigmatización?
Una gran preocupación generalizada es que se emplee edición genética para fines distintos a los terapéuticos, como inducir cambios en los organismos para “mejorar la especie humana”: por ejemplo para generar bebés más inteligentes o para elegir sus características como el color de los ojos o la estatura. Las legislaciones nacionales e internacionales del uso de algunas tecnologías permiten, entre otras cosas, proteger la salud y los intereses morales y éticos de los individuos. Hoy más que nunca parece imprescindible el desarrollo de legislación que regule las aplicaciones de la edición genética, con el propósito de aprovechar los beneficios y al mismo tiempo prevenir sus riesgos y cualquier uso inhumano de la tecnología.
El doctor He planea seguir revisando el estado de salud de Lulu y Nana hasta que tengan 18 años y después, si ellas lo aprueban. Tendremos que esperar para saber qué piensan ellas sobre las modificaciones que les hicieron cuando no eran más que un cigoto y para ver los efectos de esas modificaciones. Sólo entonces podremos ver los resultados de uno de los experimentos más controvertidos de la historia.
Más información
- Vidal Liy, Macarena, “Científicos chinos aseguran haber creado los primeros bebés modificados genéticamente”, El País, 26 de noviembre de 2018, en: https:// elpais.com/elpais/2018/11/26/ ciencia/1543224768_174686.html
- Reynaud Garza, Enrique, “Bienvenidos a la nueva era de la ingeniería genética”, Academia de Ciencias de Morelos, A.C., en: www.acmor.org.mx/ descargas/17_feb_13_crisprcas.pdf
Elisa Núñez-Acosta tiene un doctorado en biomedicina por la UNAM y le interesan la bioética relacionada con la implementación de nuevas tecnologías y la divulgación de la ciencia.
Claroscuros de la edición genética
Una técnica tan poderosa que es necesario establecer cuanto antes lineamientos para su uso que consideren factores éticos, sociales y sanitarios.
La química modifica la estructura de las sustancias rompiendo los enlaces que forman las moléculas, tras lo cual se crean nuevos enlaces en un orden distinto al que tenían. Asi se obtienen nuevas sustancias con propiedades completamente diferentes.
Esta ruptura y formación de enlaces puede ser relativamente fácil, como en la reacción entre hidrógeno y oxígeno para formar agua. Pero también puede ser sumamente complicada, como en el caso de las proteínas y los ácidos nucleicos, y en particular la molécula de ADN.
El hallazgo
La molécula de ADN está formada por una larguísima cadena de unidades llamadas nucleótidos, cada uno de los cuales contiene una de cuatro moléculas llamadas adenina, guanina, citosina y timina. Estas moléculas son como las letras del alfabeto genético: su secuencia en el ADN es como la secuencia de letras en un texto y contiene toda la información genética del individuo.
Un gen, por otro lado, es un tramo de ADN, una secuencia de varias letras. Los genes contienen la información que necesitan las células para fabricar proteínas específicas. La manipulación genética consiste en alterar, quitar o sustituir genes en el ADN de una célula.
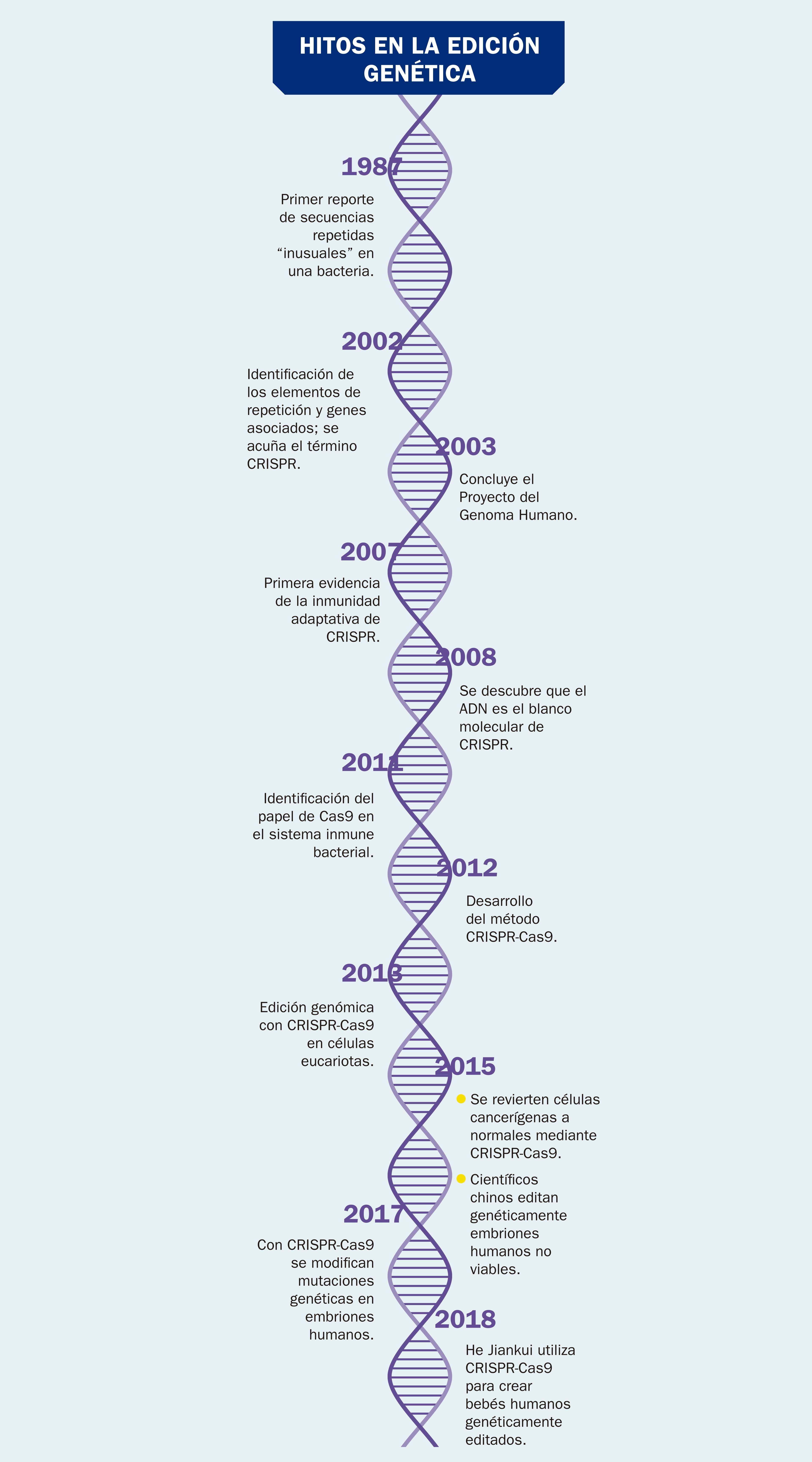
La técnica de manipulación genética conocida como CRISPR-Cas9 sirve para cortar tramos específicos y predeterminados de ADN, permitiendo que en el sitio de corte se puedan insertar tramos diferentes con funcionalidades particulares. Para ello se emplean unas enzimas llamadas nucleasas que permiten a los científicos hacer el cambio de secuencia del ADN de manera rápida y fácil, en sitios concretos del genoma de un organismo vivo (véase ¿Cómo ves?, Núm. 200). CRISPR son las siglas en inglés de Repeticiones Palindrómicas Cortas Agrupadas y Regularmente Intersepaciadas y Cas9 indica el tipo de nucleasas utilizadas.
Esta técnica está basada en un mecanismo de defensa contra virus que se encontró en algunas bacterias (por ejemplo, el Streptococcus pyrogenes y la Escherichia coli). Fue necesario mucho tiempo y trabajo para dilucidar cómo se defienden estas bacterias. El descubrimiento de que la defensa se encontraba en unas enzimas muy específicas fue el primer paso, pero verificar que dichas enzimas tienen la capacidad de distinguir perfectamente entre el material genético de la bacteria y el de los virus atacantes fue crucial. Se pudo entonces constatar que las enzimas, una vez diferenciados los materiales genéticos, proceden directamente a la destrucción del material extraño sin atacar el propio. Los pioneros de esta técnica, destacadamente la estadounidense Jennifer Doudna y la francesa Emmanuelle Charpentier, encontraron una manera de manipular esta capacidad. Lo grandioso de la técnica es que se puede cortar y modificar el gen exacto que se quiere modificar en lugar de permitir que las alteraciones sucedan al azar.
Una vez que se ha llevado a cabo la modificación del ADN mediante CRISPR, se introduce el nuevo ADN en la célula y en adelante esta lo usa como propio, fabricando o dejando de fabricar las proteínas correspondientes. Poder hacer modificaciones en sitios específicos permitirá corregir errores en genes que causan enfermedades, o incluso eliminar estos genes cuando el organismo está aún en estado embrionario. Esta técnica promete ser muy importante para la medicina genómica y para la prevención de enfermedades, pero en cuestión de edición genética de bebés, parece que está un poco en pañales. ¡O tal vez no tanto!
A finales de 2018 una noticia causó conmoción en el mundo de la ciencia: el investigador chino He Jiankui informó del nacimiento de dos gemelas cuyo ADN editó con CRISPR cuando apenas eran un grupo de células con el objetivo de hacerlas resistentes al virus del VIH, causante del sida. Estas bebés, se supone, tendrán una gran resistencia a dicho virus. Falta que se compruebe, lo que sólo se podría hacer exponiéndolas al virus, procedimiento que sería contrario a la ética... igual que editar embriones humanos.
Si bien CRISPR se ha empleado con un éxito relativo en fase de experimentación, hace falta más trabajo para poder asegurar su éxito en todos los casos.
Diversos experimentos realizados dan cuenta del éxito logrado en los últimos años. Retrasar el oscurecimiento de los champiñones, combatir la anemia falciforme en ratones, producir materias primas para polímeros y otros productos químicos, mediante modificación de levaduras y técnicas de biología sintética son solamente algunas de las aplicaciones que se han ensayado con éxito, pero siempre en organismos no humanos.
Cuando se trabaja con humanos es absolutamente necesario poder garantizar el éxito. No hacerlo así es injusto para el organismo que se está modificando. Y donde decimos organismo debe entenderse que estamos hablando de un bebé completamente indefenso.
Una opinión
Carlos Antonio Santamaría, con apenas 12 años de edad, ingresó al primer semestre de la carrera de Física Biomédica de la UNAM en agosto de 2018. Tiene un gran interés por la genética por lo cual le preguntamos su opinión acerca del caso de Lulu y Nana. Esta fue su respuesta:
“La idea de usar una modificación genética a manera de vacuna para causar inmunidad frente a una enfermedad es buena en principio, pero se debe tomar la responsabilidad frente a varias cosas. Primero, la posibilidad de que el gen modificado o insertado regule otras funciones y cause problemas a largo plazo. Asimismo se debe pensar en los padres, que deben correr el riesgo de que sus hijos puedan nacer con defectos debido a que fueron parte de una investigación experimental.
También debe considerarse el efecto que podría tener el desarrollo de esta tecnología a largo plazo. Pensando en lo que sucedió con el Proyecto del Genoma Humano y cómo la secuenciación del genoma se volvió comercial, ¿qué pasaría si la tecnología de modificación genética se volviera comercial? Si el poder económico se sobrepusiera a la ética y a la medidcina sería lamentable, ya que tendríamos los llamados bebés de diseño a gusto de los padres. Como en un principio esta tecnología sería muy cara, podríamos terminar con una brecha más amplia entre ricos y pobres, no sólo económica, sino una que surge de la esencia misma del ser humano.
Por último, también se nos presenta la pregunta de si un humano modificado genéticamente se puede seguir considerando un humano en el sentido normal de la palabra”.
Modelos animales
El antecedente más cercano de empleo de la técnica CRISPR-Cas9 para hacer modificaciones en un organismo parecido a un ser humano ocurrió en 2013, aunque se hizo público hasta 2014. Según un reporte elaborado por Christina Larson y Amanda Schaffer y publicado en la revista MIT Technological Review, en abril de ese año un experimento llevado a cabo en un laboratorio de Yunnan, China —en el que participaron Jennifer Doudna, de la Universidad de California en Berkeley, Feng Zhang, del Instituto Tecnológico de Massachusetts y George Church, de la Universidad Harvard— logró producir dos gemelos macacos con alteraciones genéticas generadas con esta biotecnología. La secuencia experimental consistió en la fertilización in vitro para editar tres genes distintos mediante CRISPR-Cas9, seguida de la implantación de los óvulos en una madre sustituta. Esta forma de producir macacos genéticamente modificados abre la posibilidad de estudio de distintas enfermedades en humanos, pero a la vez plantea dilemas éticos de importancia. Jennifer Doudna dijo entonces: “La idea de que podemos modificar primates fácilmente con esta tecnología resulta muy potente. Que sea buena idea es una pregunta mucho más difícil de responder”.
Por ejemplo podrían producir monos con mal de Alzheimer o de Parkinson para estudiarlos y encontrar cómo curar y prevenir estas enfermedades. Se ha encontrado que en muchas ocasiones se presentan algunas mutaciones genéticas asociadas a este tipo de enfermedades, de manera que si se producen monos con esa mutación incorporada, se puede estudiar más directamente su relación con la enfermedad. Y se está buscando crear monos con mutaciones en el gen llamado SHANK3 para producirles autismo y poder estudiar mejor este transtorno.
Conejillos de indias
En la Segunda Cumbre Mundial sobre Edición del Genoma Humano, celebrada en Hong Kong hacia finales de 2018, He Jiankui hizo su aparición para hablar de su colaboración en el trabajo denominado “Edición del gen CCR5 en embriones de ratones, monos y humanos por medio de CRISPR-Cas9”. Explicó que el gen CCR5 está asociado con la posibilidad de contagio por el virus de la inmunodeficiencia humana, VIH. El primer problema vino cuando dijo que practicó esta edición genética en dos gemelas con las cuales se presentó un problema con posibles consecuencias físicas y repercusiones éticas. El equipo en que trabaja He eliminó las dos copias existentes del gen CCR5 en una de las gemelas, pero cometió un error con la otra y, de manera inadvertida (o descuidada, o tal vez, siendo mal pensados, a propósito) dejaron intacta una copia del mismo gen, lo que hace a la niña susceptible de contagiarse. Se ha criticado mucho la decisión del equipo de He de implantar el segundo embrión a sabiendas del problema. Se dijo que no tenía sentido hacerlo desde un punto de vista científico. La justificación de He fue que explicaron la situación a los padres y ellos decidieron que se implantara el embrión de todas formas.
Si pensamos bien, fue un simple error, pero si pensamos mal, parece haber sido con toda la intención, para poder evaluar lo que sucede si se elimina por completo el gen CCR5 comparando con lo que sucede si uno de los genes permanece intacto. Las bebés se convierten así en conejillos de indias.
El equipo de He trabajó con ocho parejas en las que las mujeres estaban libres de VIH y los hombres estaban infectados. Se lavó el esperma de los hombres para asegurarse de que se encontraba libre del virus y lo inyectaron junto con las enzimas CRISPR-Cas9 en óvulos no fertilizados de las mujeres. Obtuvieron varios embriones viables con la modificación genética. En el caso de una de las parejas, dos embriones tenían modificaciones en el gen CCR5. Estos fueron implantados en la mujer y produjeron a las gemelas. Aunque no se aclaró lo que sucedió con los otros embriones, He dijo que implantó un embrión editado (sin aclarar el tipo de edición) en otra mujer.
Hay muchas preguntas sin respuesta acerca de este trabajo. Por ejemplo ¿por qué eligió parejas en las que el hombre está infectado pero la mujer no, si se sabe que la enfermedad se transmite al feto con más probabilidad si la madre la tiene? Y ¿por qué la prisa? Si bien se conoce la relación entre CCR5 y VIH, aún se ignoran otras funciones de ese gen, así como las consecuencias de su ausencia.
Luego de la presentación de este trabajo, la Comisión Nacional de Salud de China emprendió una investigación. La Academia de Ciencias de China emitió un comunicado condenando este trabajo, mientras que la Sociedad Genética de China y la Sociedad China para Células Madre declararon que este experimento “viola los principios éticos aceptados internacionalmente, que regulan la experimentación humana y las leyes de derechos humanos”.
Consecuencias
La primera consecuencia, casi inmediata, del experimento con las gemelas es que He Jiankui está viviendo bajo vigilancia en un departamento en la ciudad de Shenzhen (su paradero se mantuvo secreto durante varios días). La segunda es que queda demostrado que hace falta un consenso mundial acerca del futuro de estas técnicas de manipulación genética en humanos, lo que ha llevado a la Organización Mundial de la Salud a establecer un panel de expertos que analicen los usos potenciales de la edición genética en humanos y formular lineamientos para el empleo de esta tecnología. Estos lineamientos deben tener en cuenta factores éticos, sociales y sanitarios. También sería deseable que, al menos por un tiempo largo, se defina exactamente qué es enfermedad y qué clase de enfermedades se deben tratar con técnicas de edición genética porque hay una diferencia sustancial entre editar genéticamente un embrión humano para evitar trastornos como el Alzheimer o el Parkinson, y editarlo para darle, por ejemplo, ojos verdes e inmunidad a la calvicie.
Seguramente este caso aún tiene mucho que dar para generar discusiones intensas acerca del potencial de esta técnica (o de otras similares que se desarrollen en el tiempo) y de la pertinencia de su aplicación en seres humanos. Pero queda claro que la actividad científica llevada a cabo con menoscabo de la ética conduce a problemas muy complicados.
Más información
- Montoliu, Lluís, Editando genes: recorta, pega y colorea. Las maravillosas herramientas CRISPR, Next Door Publishers, España, 2019.
- Young, Susan, “Cirugía del genoma”, MIT Technological reviews, Cambridge, MA, 2014, en: www.technologyreview. es/s/4048/cirugia-del-genoma
- Organización Mundial de la Salud, “Un grupo de expertos de la OMS prepara el terreno para una firme gobernanza mundial de la edición del genoma humano”, en: www.who.int/es
Benjamín Ruiz Loyola es profesor de la Facultad de Química de la UNAM desde hace más de 40 años. Divulgador y colaborador frecuente de ¿Cómo ves? En enero de 2016 fue designado miembro del Comité Asesor en Educación y Divulgación de la Organización para la Prohibición de las Armas Químicas hasta diciembre de 2018.
Jorge Benjamín Ruiz Gutiérrez estudió Ciencias de la Comunicación y el Diplomado en Divulgación de la Ciencia de la DGDC/UNAM. Ávido lector, le fascina la ciencia de la vida cotidiana, como la química de la cocina y la biomecánica de los gatos.